RESEARCH FRONT
研究前沿
发酵大豆对老年人认知能力的影响:随机对照试验的结果
发酵大豆对老年人认知能力的影响:随机对照试验的结果
Laura M. West 1 , Joan Sabaté 1 , Ifeanyi D. Nwachukwu 2 , Grace J. Lee 3 , Rawiwan Sirirat 1 , Amandeep Wright 1 and Sujatha Rajaram 1, *
1洛马林达大学公共卫生学院,洛马林达,加利福尼亚州92350,美国;laurawest@llu.edu(L.M.W.);jsabate@llu.edu(J.S.);rsirirat@llu.edu(R.S.);amawright@llu.edu(A.W.)
2美国俄亥俄州鲍灵格林州立大学公共与联合卫生系,邮编43403;idnwach@bgsu.edu
3洛马琳达大学行为健康学院心理学系,美国加利福尼亚州洛马琳达,邮编92350;gracelee@llu.edu
*通信:srajaram@llu.edu
摘要
背景/目的:大豆食品和异黄酮与认知功能呈负相关下降;然而,随机对照试验(RCTs)的结果喜忧参半。发酵的大豆含有未发酵大豆中没有的生物活性化合物,如肽以及苷元异黄酮,可能通过减少神经炎症来支持认知以及氧化应激。轻度认知障碍老年人发酵大豆随机对照试验显示认知益处;然而,发酵大豆对认知健康老年人的影响成年人是未知的。方法:我们研究了非益生菌发酵的影响,添加到日常饮食中的大豆粉与全球能量匹配的安慰剂相比,12周内的认知、记忆、言语表达、处理速度和执行功能,对61名65岁及以上成年人(74±5岁;47名完成者)进行随机对照试验。结果:发酵大豆组在记忆评分方面表现出显著改善(p=0.041)
(1.81%,95%CI:−2.10,5.72)与安慰剂(1.16%,95%置信区间:−3.64,5.97)的差异分析,调整后性别和
基线得分。对70岁及以上女性(n=29)的事后分析发现在整体认知(p=0.028)和记忆(p=0.049)方面在发酵大豆组。根据基线得分调整后的全球认知平均变化为发酵大豆为2.86%(95%CI:1.52,4.21),安慰剂为0.06%(95%CI:-1.43,1.55)。根据基线评分调整后的记忆平均变化为8.47%(95%置信区间:5.05,11.89)发酵大豆组,而安慰剂组为2.05%(95%置信区间:-1.75,5.84)。结论:这些结果表明,发酵大豆有可能减缓与年龄相关的认知能力记忆力下降,尤其是70岁及以上女性的记忆力。进一步研究以证实这些对老年女性、男性和其他年龄段的调查是有必要的。
关键词:发酵大豆;认知;记忆;大豆;异黄酮;老年人;痴呆
1.导言
预期寿命的延长导致了人口老龄化,全球痴呆症预计病例将从2019年的5740万增加到2050年的1.528亿[1]。营养其他生活方式因素已被证明可以改变认知能力下降的风险[2]。以全植物性食物为主的健康饮食模式显示出神经保护作用效果[3-6]。这些以植物为中心的饮食模式富含抗氧化营养素,n-3多不饱和脂肪酸和包括多酚在内的抗炎症植物营养素以及其他生物活性化合物[7,8]。植物营养素被认为有助于健康通过减少氧化应激和神经损伤,这与神经元损伤有关,并可能增加与年龄相关的风险认知能力下降(ARCD)[7-9]。
大豆食品在亚洲传统饮食中被广泛食用,富含异黄酮(大豆黄酮和染料木素)、具有抗氧化和雌激素样特性的酚类黄酮类化合物,心血管[10]、骨骼[11]和认知健康,尤其是记忆[12]。尽管大豆与认知的观察性研究和临床试验的这一潜力由于关键异黄酮的生物利用度有限,在老年人中仍然不一致[13,14],其天然糖苷形式。发酵通过以下方式提高大豆的营养价值,将异黄酮糖苷转化为更容易吸收的苷元生物活性[15-17]。这一过程还增强了抗氧化和抗炎症作用,这些特性为改善神经保护作用提供了一种合理的机制。
虽然动物研究强烈支持发酵大豆的认知益处[18-26],人类研究主要针对轻度认知障碍(MCI)患者。为期12周的益生菌发酵大豆粉试验提高了注意力和记忆力,复合物和脑源性神经营养因子(BDNF)在老年人中的增加MCI[27]。同样,为期六个月的tempeh干预改善了老年男性的全球认知能力以及患有MCI的绝经后妇女[28]。据我们所知,这是第一次随机对照试验(RCT),研究非益生菌发酵大豆对认知的影响,在认知健康的老年人群体中使用该产品,解决了文献和扩大发酵大豆摄入的潜在预防相关性。我们之前已经证明Q-Can Plus®,一种发酵的非益生菌大豆制品,显著降低LDL胆固醇[29],降低炎症标志物,包括白介素-1受体拮抗剂和白介素-6[30],两者都与保护作用有关对抗大脑衰老[31-34]。此外,Q-Can Plus®已被证明可以调节肠道通过增加双歧杆菌和其他有益细菌的微生物群[35],这是已知的因为它们的神经保护作用[36,37],但通常会随着年龄的增长而下降[38,39]。宗旨这项研究的目的是确定是否经常摄入发酵大豆制品Q-Can Plus
®增强认知功能,包括全局认知和领域特定认知成年人的功能(记忆、言语扩散、处理速度和执行功能)
65岁及以上。
2.材料和方法
2.1研究方案
这项为期12周、自由生活、平行、三盲、安慰剂对照的随机对照试验,男性和绝经后65岁及以上女性旨在探讨发酵豆制品对免疫和认知的影响(ClinicalTrials.gov NCT04866576)。仅限这里将讨论认知结果。Loma机构审查委员会琳达大学批准了这项研究,所有参与者都提供了书面通知注册前的同意。研究对象来自美国加利福尼亚州Loma Linda,以及周边地区。健康男性和绝经后女性,65岁老年人和非老年人有资格参与研究。(图1)排除标准包括:(1)已知对大豆或乳制品不耐受或过敏;(2)免疫系统不合格/疾病;(3)胰岛素依赖型糖尿病;(4)神经退行性变疾病和MCI;(5)肾透析;(六)肿瘤放疗或者化疗;(7) 强的松或强的松龙治疗大于10毫克/天在6个月内学习。受试者被要求继续他们的日常饮食、体力活动和其他生活习惯,并且在研究期间不服用任何已知会影响认知和免疫力的补充剂。我们成功地申请了招聘和学习本研究中使用的方案在以前的几个随机对照试验中[29,40]。
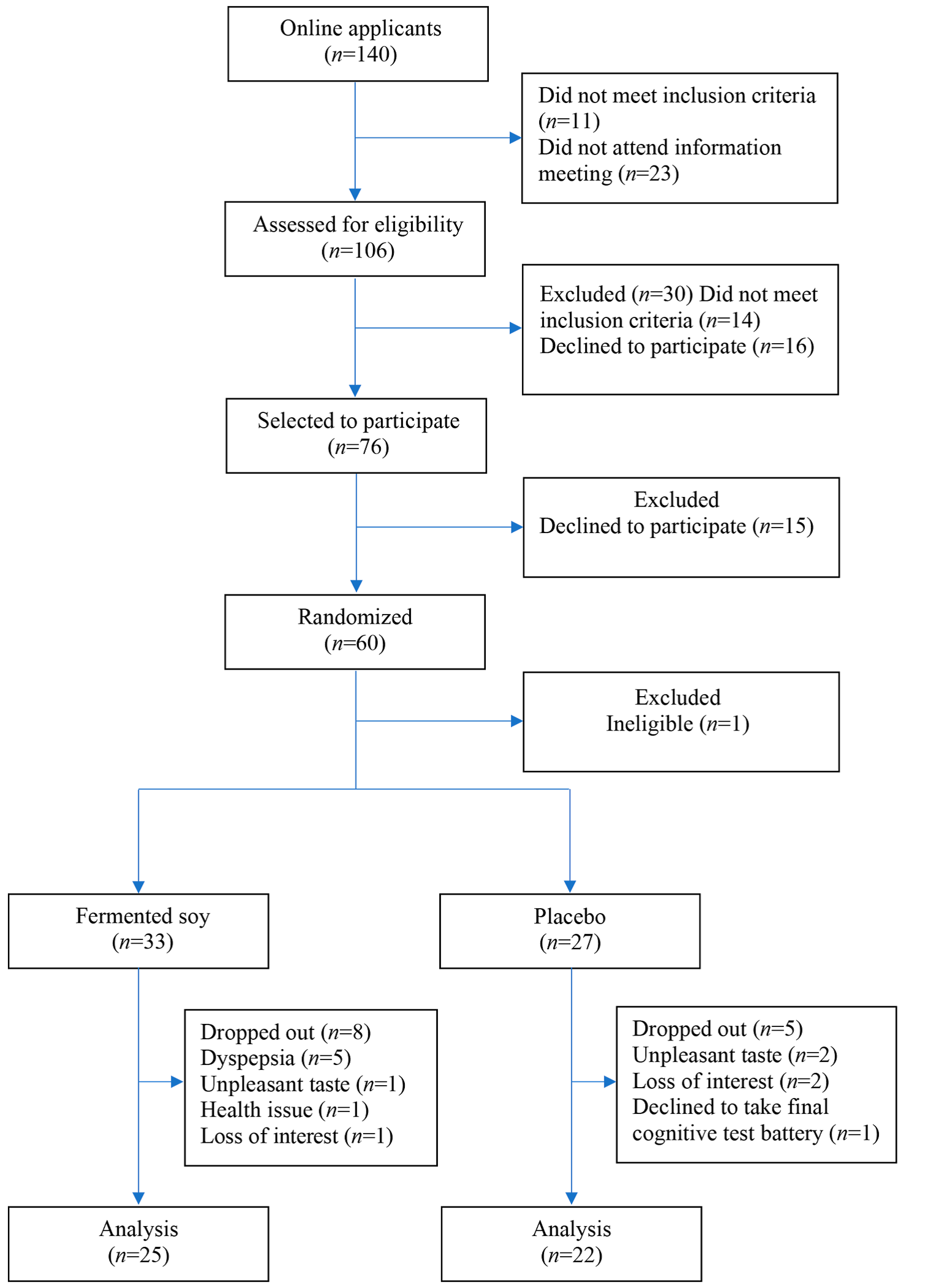
图1:研究流程图。
140人申请参加研究,106人进行了资格评估,其中76人获选参加。63个合格,个人同意参与研究,其中两人拒绝完成认知测试电池。其余61名参与者被随机分为两组,发酵大豆组(n=33)和对照组(n=28)。计算样本量对于其他主要结果,免疫标记物(包括10%的退出率)为:估计为62。
选定的受试者被随机分为发酵大豆组和安慰剂组,按性别分层。对参与者、临床医生和统计学家进行随机分组。家庭成员,如伴侣或朋友,被随机分配一起进入同一组。随机分组后,参与者完成问卷调查人口统计和生活习惯,包括饮食、体力活动、压力、睡眠和酒精、烟草和咖啡因的使用。除人口统计数据外,调查问卷为:第12周重复。
训练有素的研究临床医生测量参与者的身高、体重和身体成分在基线检查和第12周就诊时。测量体重精确至100g使用Body®570身体成分分析仪(美国加利福尼亚州Cerritos)。测量高度,使用壁挂式视距计,精确至0.1 cm。
受试者食用两包预先测量的Q-Can Plus®发酵豆粉或乳清基安慰剂粉末,每天12周。Q-Can Plus®获得BESO专利Biological Research Inc.(Diamond Bar,CA,USA)发酵的混合有益生物,但不含活培养物,因此不是益生菌。对照组服用两包乳清基安慰剂粉末等热量,外观可与发酵豆粉媲美。发酵豆粉含110千卡、8.4克碳水化合物、4.5克脂肪、9.4克蛋白质、5.6克纤维和36.3毫克每日异黄酮,中等剂量的异黄酮,在传统亚洲饮食【41】。在MCI患者的研究中,可能需要更高的剂量。安慰剂粉末含有106千卡、15.6克碳水化合物、1.0克脂肪、8.5克蛋白质、0克纤维和0毫克异黄酮。发酵大豆粉和安慰剂粉都用可可粉和僧侣调味水果甜味剂。参与者被要求将他们的包与8盎司的水混合或普通饮料,如牛奶或植物奶。所有参与者均接受指导,在学习期间保持他们通常的饮食和生活习惯,并尽量减少食用大豆食品。大多数参与者报告了基线调查,他们很少或从未吃过豆制品,也没有人服用过异黄酮补充剂。参与者报告食用大豆食品的世卫组织被指示将食用量控制在最低限度,研究期间,即每周不超过一次。参与者记录任何疾病及其与干预产品摄入量、日常饮食、生活方式的偏差,以及生活方式杂志上的药物。
受试者每月与研究临床医生会面,在会面时,他们选择饮料包装,退回未使用的包装,并填写有关其体验的问卷对其干预产品的耐受性。遵守干预措施,通过计算未使用、退回的数据包和对他们生活方式日志的主观评估来确定。
一组90分钟的综合神经心理学测试用于:受试者在基线和第12周时的心理测量师对受试者的干预不知情组。受试者从基线检查到第12周的总体认知测试成绩的平均变化,以及在记忆、语言流畅性、加工等认知领域的平均变化速度和执行功能。减少变异性、基线和研究结束认知测试安排在同一天的同一时间,参与者有相同的心理测量师对于两个测试会话。参与者被要求了解其他情况影响认知,如睡眠时间和咖啡因摄入量,与基线和研究结束测试。
我们以前曾成功地将这种认知测试组合用于老年人[42]。记忆组合中的认知测试包括Rey听觉语言学习测试和简短视觉空间记忆测试的即时和延迟回忆分数-修订版。由FAS音位语言流畅性测试和动物命名测试组成语言流畅性成分。加工速度测试包括符号数字模态测试、线索形成测试(TMT)A部分和Stroop测试(黄金版)A部分和B部分。执行功能测试包括TMT B部分、Stroop测试C部分、韦氏成人智力量表第四版数字广度和听觉辅音三叉图。通过创建所有四个认知域的组合来评估整体认知。流行病学研究中心的抑郁量表用于评估抑郁症状[43]。
2.2统计分析
主要结果是评估整体认知和记忆、语言流畅性、处理速度和执行功能等认知领域的平均变化,通过一组经过验证的认知测试进行测量。计算其他主要结果的样本量,免疫标记物,包括10%的退出率,估计为62。认知复合结果的功率是事后计算的。所有分析均为意向性治疗,包括完成研究结束认知测试组合的所有参与者,无论其依从性如何。最大比例法用于将原始测试分数转换为从0(最小可能)到1(最大可能)的度量[44]。为了便于解释,分数乘以100得到最大可能分数的百分比。对于没有最大可能得分的测试(Stroop和TMT),使用观察到的最高参与者得分代替最大可能得分。反映完成时间(以秒为单位)的TMT分数被颠倒,以便纳入复合材料中,因此分数越高反映的速度越快,即表现越好。将综合得分计算为相关标准化得分的平均值。采用双侧显著性检验,p值小于0.05定义为具有统计学意义。使用协方差分析(ANCOVA)分析从基线到干预后的平均得分变化,并根据基线得分和性别进行调整。所有数据均采用SPSS 29.0.1.0进行统计分析。
3、结果
在61名随机受试者中,大多数(n=29)是70岁及以上的绝经后妇女。随机分为安慰剂组的一名受试者最近被诊断为MCI,因此不再有资格参加。发酵大豆组的8名参与者和安慰剂组的5名参与者在最后的认知测试前退出。在发酵大豆组中,5人因消化不良而退出,1人因干预产品味道不好、与干预无关的健康问题以及对研究失去兴趣而退出。在对照组中,两名参与者因安慰剂产品的不愉快味道而退出,两名参与者因对研究失去兴趣而退出,另一名参与者因拒绝参加最后的认知测试而退出。总体辍学率为22%,这与其他老年人营养干预试验一致[45,46]。磨蚀的原因主要和干预的适口性有关。47名参与者完成了研究:发酵大豆组25名,对照组22名。完成者平均年龄74.0岁,辍学者平均年龄71.7岁,差异无统计学意义(p=0.148)。退出的13名参与者中有6名年龄<70岁。与白人和其他种族群体相比,拉美裔辍学的人数明显更多(p=0.013)。完成研究者和辍学者在所有其他方面都相似(补充表S1)。
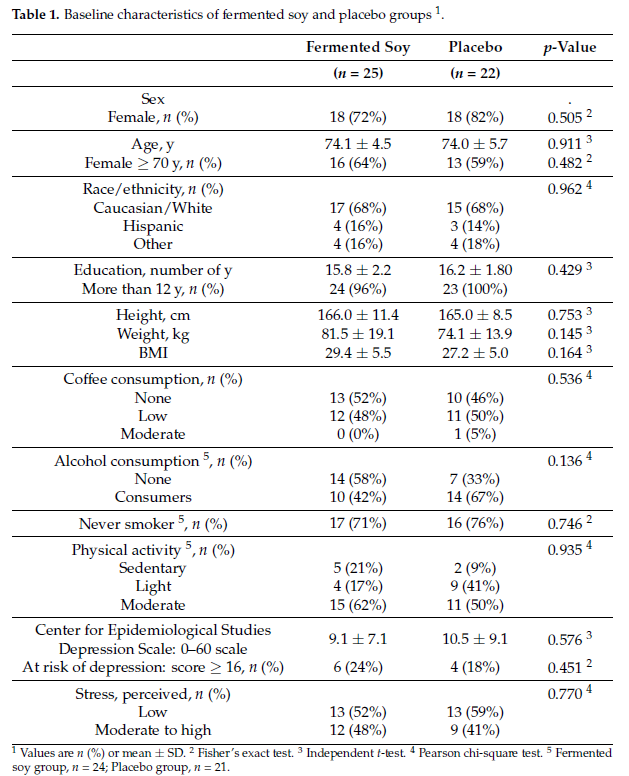
发酵大豆和对照参与者之间在补充剂之间没有显著的基线差异(表1)。虽然体重指数(BMI)不是参与的具体标准,但平均BMI在超重范围内。受试者不使用异黄酮补充剂,且报告的大豆食品膳食摄入量较低。发酵大豆组和安慰剂组的基线异黄酮摄入量相似。根据食用和退回的包装,发酵大豆组和安慰剂组对发酵大豆和安慰剂干预的依从性分别为90%(食用168包中的151包)和93%(食用168包中的156包)。
表1:发酵大豆和安慰剂组1的基线特征。
认知结果
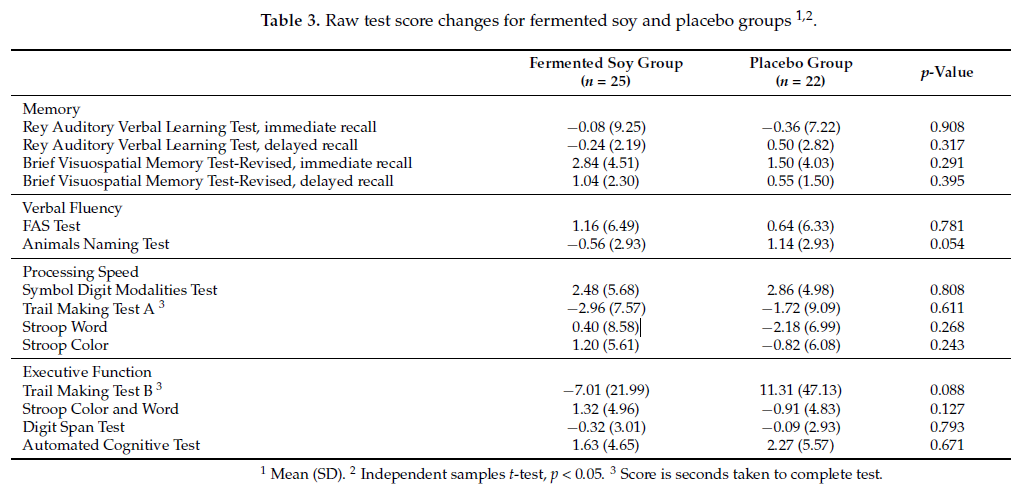
发酵大豆组和安慰剂组在总体认知或特定记忆领域、语言流畅性、处理速度和执行功能的基线综合得分(表2)或基线原始测试得分(补充表S2)方面没有显著差异。调整性别和基线得分后,发酵大豆组在记忆得分方面表现出适度但显著的改善(p=0.041,观察到的事后功率=0.71,Cohen’s d=1.02),与安慰剂组相比为1.81%(95%CI:-2.10,5.72),1.16%(95%CI:-3.64,5.97)(表2)。在其他领域或整体认知方面,两组之间的认知变化得分没有显著差异。表3显示了个人认知测试的基线原始分数。
表2:发酵大豆组和安慰剂组的认知综合评分1,2。
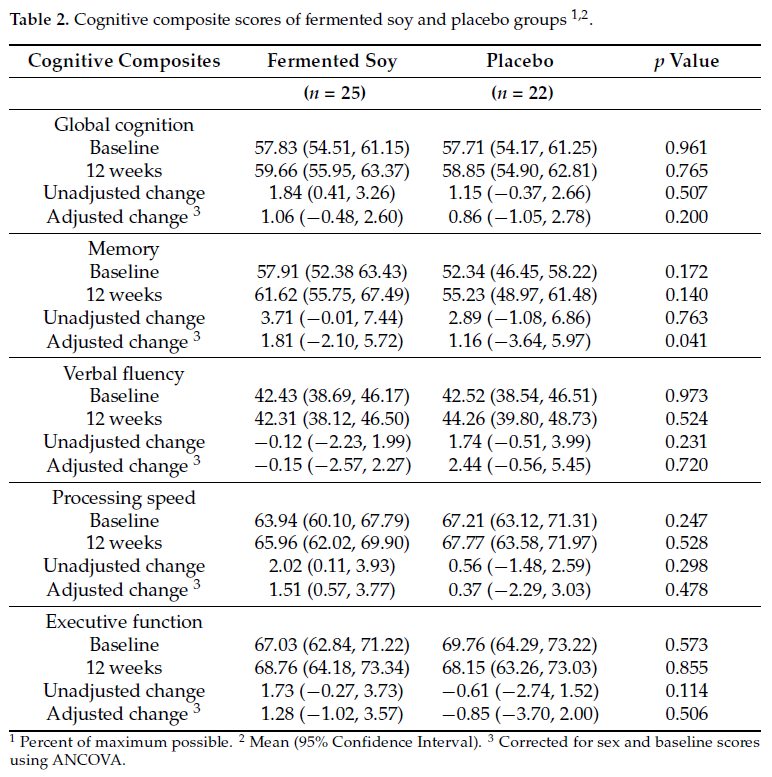
表3:发酵大豆和安慰剂组1,2的原始测试分数变化
我们的研究组由75%的女性组成,大多为70岁及以上,因此我们进行了事后分析,以确定绝经后的老年女性是否对发酵大豆干预有显著不同的反应。我们注意到发酵大豆组和安慰剂组在≥70岁的女性中,整体认知和记忆得分的平均变化存在显著差异(图2)。调整基线得分后,发酵大豆组70岁及以上女性总体认知得分的平均变化为2.86%(95%CI:1.52,4.21),而安慰剂组为0.06%(95%CI:-1.43,1.55)(p=0.028,观察到的事后功率=0.68,Cohen’s d=1.13)。发酵大豆组记忆综合评分的调整后平均变化为8.47%(95%CI:5.05,11.89),而安慰剂组为2.05%(95%CI:-1.75,5.84)(p=0.049,观察到的事后功率=0.59,Cohen’s d=1.02)。70岁及以上女性的完整认知综合数据见补充表S3。
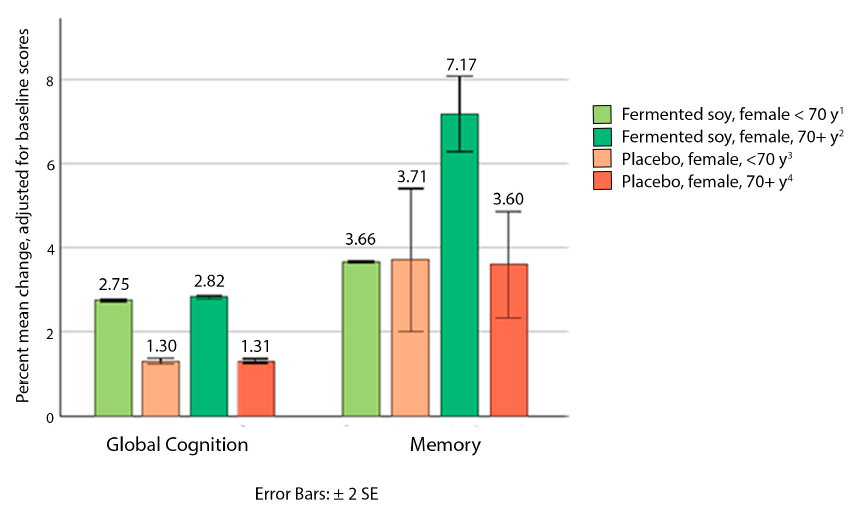
图2:绝经后妇女的整体认知和记忆变化,年龄小于70岁与大于70岁。1 n=2。2 n=16。3 n=5。4 n=13。
4、讨论
在这项为期12周的随机对照饮食干预研究中,调查了每天食用发酵豆制品对老年人认知能力的影响,观察到记忆领域有了适度但显著的改善。在探索性分析中,70岁及以上的绝经后妇女的记忆得分改善更为显著(发酵大豆组平均改善8.47%,安慰剂组平均改善2.05%)。为了进行比较,希腊的一项研究检查了老年人言语记忆得分的规范性数据,发现70-79岁年龄组的平均得分比60-69岁年龄组低6.1%至9.6%。我们的结果是探索性的,在进行确证性试验之前应谨慎解释。
与其他认知领域相比,记忆对大豆干预的反应更强[48]。在对16项关于大豆异黄酮干预和认知的随机对照试验的荟萃分析中,Cui等人发现记忆是唯一显示显著改善的领域[48]。可能存在剂量-反应关系,高剂量干预(≥100 mg异黄酮/天)比低剂量干预具有略高的认知表现[48]。在我们的研究中,发酵大豆干预含有36.3毫克异黄酮/天,这将被归类为低剂量的荟萃分析。然而,这些随机对照试验大多研究异黄酮补充剂。据估计,不超过10%的亚洲人每天摄入100毫克的异黄酮[41]。据估计,日本老年人平均每天摄入25-50毫克异黄酮[41],因此我们的干预措施可视为中等摄入量。此外,与未发酵的大豆相比,发酵可增加人类尿液中苷元异黄酮的排泄量和回收率,证明生物利用度提高[49]。发酵大豆的生物利用度提高,即使在中等摄入量的情况下,也有可能产生生理效益。
发酵大豆可能通过多种互补机制支持认知。从发酵中提取的苷元异黄酮、肽和氨基酸具有抗氧化和抗炎活性,有助于对抗氧化应激,这是导致神经退行性衰老疾病的重要因素[15,19,50–52]。例如,在动物模型中,发酵的大豆制品,如豆豉,可以通过促进抗氧化酶的表达和减少神经炎症来增强记忆。[20,21]。此外,动物和体外研究已证明大豆肽具有降压和ACE抑制特性,考虑到高血压和痴呆风险之间的联系,大豆肽可改善血管功能并间接支持大脑健康[50,53]。
异黄酮还与雌激素受体β(ERβ)相互作用,雌激素受体β在海马和小脑中丰富,是记忆和学习的关键区域[54,55]。ERβ的激活可能有助于一些大豆研究中观察到的记忆特异性效应。最后,与年龄相关的变化,如氧化应激增加、炎症、脂质代谢和肠道微生物群的改变是认知能力下降的已知危险因素。发酵豆制品,如Q-Can Plus®已证明有能力有利地调节这些途径[29,30,35],如果在不可逆损伤发生之前给予ARCD,则可提供潜在的预防益处。
据我们所知,这是第一个在认知健康的老年人群体中调查非益生菌发酵豆制品对整体和特定领域认知的影响的RCT。这项研究的优势包括使用三盲、安慰剂对照、随机设计,以及在不同认知领域使用广泛的标准化认知测试,我们在之前针对老年人的试验中成功地使用了这些测试[42]。该研究的局限性之一是只有47名完成者,大多数是70岁以上的女性,这限制了统计能力和外部效度。我们承认,在70岁及以上的女性中观察到的整体认知和记忆得分的改善是适度的,并且,从探索性分析中得出的结果,应该谨慎解释。需要进一步的研究来证实这些发现。与之前使用发酵豆粉的试验相比,本研究中我们的退学率也更高[29]。在辍学者中,有6名参与者年龄在70岁以下,与其他种族群体相比,辍学的拉美裔人要多得多,这可能会引入偏见。西班牙裔人口
通常在临床试验中代表性不足,因此在后续研究中应优先考虑招募和保留[56]。由于这是一项为期12周的干预,因此只能观察到对认知的短期影响。我们的研究也受到限制,只利用主观评估的摄入量,并没有包括生物标志物的大豆摄入量。未来的研究应考虑在更大样本中进行长期干预,使用BDNF和异黄酮等生物标志物来支持和进一步证实我们的观察结果,阐明与年龄和性别相关的结果差异的潜在原因,以及考虑对阿尔茨海默病临床前标志物的影响。
5、结论
我们证明发酵大豆可以改善老年人的记忆,在70岁及以上的绝经后妇女中观察到更强的记忆和整体认知改善。这些发现产生了假设;因此,因果关系无法推断,特别是考虑到小样本和探索性亚组分析。
记忆对日常决策和功能至关重要,因此定期摄入发酵大豆可能是延缓认知衰退的一种经济有效的方法。由于之前的研究支持Q-Can Plus®的降胆固醇、抗氧化、抗炎和肠道健康作用,因此有可能考虑将发酵大豆作为饮食的一部分,以保护心脏健康和认知。
补充材料:以下支持信息可在以下网址下载:https://www.mdpi.com/article/10.390/nu17182936/1,表s1:完成者和退出者的基线特征;表S2:发酵大豆组和安慰剂组的基线原始测试得分;表S3:70岁及以上女性发酵大豆组和安慰剂组的认知综合得分。
作者贡献:概念化,J.S.和I.D.N。;方法论,J.S.和I.D.N。;形式分析,L.M.W.和G.J.L。;调查,L.M.W.、R.S.和A.W。;书面形式——L.M.W.起草初稿。;写作——审查和编辑、I.D.N.、G.J.L.和S.R。;监督,L.M.W.、G.J.L.、R.S.和A.W。;项目管理,L.M.W.、J.S.、R.S.和A.W。;所有作者均已阅读并同意手稿的已出版版本。
资金:这项研究由BESO生物研究公司(美国加利福尼亚州钻石吧)资助,该公司生产发酵大豆产品Q-Can Plus®。基金编号:1000896。
机构审查委员会声明:本研究根据《赫尔辛基宣言》进行,并得到洛马林达大学机构审查委员会的批准(方案代码5210161,批准日期为2021年5月25日)。
知情同意书:从参与研究的所有受试者处获得知情同意书。
数据可用性声明:本研究中提供的数据可应通讯作者的要求提供。由于道德原因,这些数据不公开。
致谢:我们感谢Shashonk Illam和Brooke Iwamoto管理认知测试电池。
利益冲突:作者声明没有利益冲突。作者宣布,这项研究得到了BESO生物研究的资助。资助者在研究设计中没有任何作用;收集、分析或解释数据;在撰写手稿时;或者在决定公布结果时。
缩写
本手稿中使用了以下缩写:
ARCD:与年龄相关的认知能力下降
MCI:轻度认知障碍
BDNF:脑源性神经营养因子
RCT:随机对照试验
TMT :路径制作测试
ANCOVA:协方差分析
ERβ:雌激素受体β
参考文献
1. GBD 2021 Nervous System Disorders Collaborators. Global, regional, and national burden of disorders affecting the nervous system, 1990–2021: A systematic analysis for the Global Burden of Disease Study 2021. Lancet Neurol. 2024, 23, 344–381. [CrossRef]
2. Dominguez, L.J.; Veronese, N.; Vernuccio, L.; Catanese, G.; Inzerillo, F.; Salemi, G.; Barbagallo, M. Nutrition, Physical Activity, and Other Lifestyle Factors in the Prevention of Cognitive Decline and Dementia. Nutrients 2021, 13, 4080. [CrossRef]
3. Fieldhouse, J.L.P.; Doorduijn, A.S.; De Leeuw, F.A.; Verhaar, B.J.H.; Koene, T.;Wesselman, L.M.P.; De Van Der Schueren, M.A.; Visser, M.; Van De Rest, O.; Scheltens, P.; et al. A Suboptimal Diet is Associated with Poorer Cognition: The NUDAD Project. Nutrients 2020, 12, 703. [CrossRef]
4. Mcgrattan, A.M.; McGuinness, B.; McKinley, M.C.; Kee, F.; Passmore, P.; Woodside, J.V.; McEvoy, C.T. Diet and Inflammation in Cognitive Ageing and Alzheimer’s Disease. Curr. Nutr. Rep. 2019, 8, 53–65. [CrossRef]
5. Morris, M.C.; Tangney, C.C.; Wang, Y.; Sacks, F.M.; Barnes, L.L.; Bennett, D.A.; Aggarwal, N.T. MIND diet slows cognitive decline with aging. Alzheimer’s Dement. 2015, 11, 1015–1022. [CrossRef]
6. Valls-Pedret, C.; Sala-Vila, A.; Serra-Mir, M.; Corella, D.; De La Torre, R.; Martinez-Gonzalez, M.A.; Martinez-Lapiscina, E.H.; Fito, M.; Perez-Heras, A.; Salas-Salvado, J.; et al. Mediterranean Diet and Age-Related Cognitive Decline: A Randomized Clinical Trial. JAMA Intern. Med. 2015, 175, 1094–1103. [CrossRef]
7. Nurk, E.; Refsum, H.; Drevon, C.A.; Tell, G.S.; Nygaard, H.A.; Engedal, K.; Smith, A.D. Cognitive performance among the elderly in relation to the intake of plant foods. The Hordaland Health Study. Br. J. Nutr. 2010, 104, 1190–1201. [CrossRef] [PubMed]
8. Rajaram, S.; Jones, J.; Lee, G.J. Plant-Based Dietary Patterns, Plant Foods, and Age-Related Cognitive Decline. Adv. Nutr. 2019, 10 (Suppl. S4), S422–S436. [CrossRef] [PubMed]
9. Okubo, H.; Inagaki, H.; Gondo, Y.; Kamide, K.; Ikebe, K.; Masui, Y.; Arai, Y.; Ishizaki, T.; Sasaki, S.; Nakagawa, T.; et al. Association between dietary patterns and cognitive function among 70-year-old Japanese elderly: A cross-sectional analysis of the SONIC study. Nutr. J. 2017, 16, 56. [CrossRef] [PubMed]
10. Yamagata, K. Soy Isoflavones Inhibit Endothelial Cell Dysfunction and Prevent Cardiovascular Disease. J. Cardiovasc. Pharmacol. 2019, 74, 201–209. [CrossRef]
11. Zheng, X.; Lee, S.K.; Chun, O.K. Soy Isoflavones and Osteoporotic Bone Loss: A Review with an Emphasis on Modulation of Bone Remodeling. J. Med. Food 2016, 19, 1–14. [CrossRef] [PubMed]
12. Nakamoto, M.; Otsuka, R.; Nishita, Y.; Tange, C.; Tomida, M.; Kato, Y.; Imai, T.; Sakai, T.; Ando, F.; Shimokata, H. Soy food and isoflavone intake reduces the risk of cognitive impairment in elderly Japanese women. Eur. J. Clin. Nutr. 2018, 72, 1458–1462. [CrossRef] [PubMed]
13. Rietjens, I.M.C.M.; Louisse, J.; Beekmann, K. The potential health effects of dietary phytoestrogens. Br. J. Pharmacol. 2017, 174, 1263–1280. [CrossRef]
14. Szczerba, E.; Koch, M.; Schlesinger, S. Soy consumption, cognitive function, and dementia. Curr. Opin. Lipidol. 2022, 33, 68–75. [CrossRef]
15. Hsiao, Y.-H.; Ho, C.-T.; Pan, M.-H. Bioavailability and health benefits of major isoflavone aglycones and their metabolites. J. Funct. Foods 2020, 74, 104164. [CrossRef]
16. do Prado, F.G.; Pagnoncelli, M.G.B.; Pereira, G.V.d.M.; Karp, S.G.; Soccol, C.R. Fermented Soy Products and Their Potential Health Benefits: A Review. Microorganisms 2022, 10, 1606. [CrossRef] [PubMed]
17. Jayachandran, M.; Xu, B. An insight into the health benefits of fermented soy products. Food Chem. 2019, 271, 362–371. [CrossRef]
18. Lee, D.-H.; Kim, M.J.; Park, S.; Song, E.; Nam, Y.; Ahn, J.; Jang, Y.; Ha, T.; Jung, C.H. Bioavailability of Isoflavone Metabolites After Korean Fermented Soybean Paste (Doenjang) Ingestion in Estrogen-Deficient Rats. J. Food Sci. 2018, 83, 2212–2221. [CrossRef]
19. Zhou, X.; Du, H.-H.; Jiang, M.; Zhou, C.; Deng, Y.; Long, X.; Zhao, X. Antioxidant Effect of Lactobacillus fermentum CQPC04-Fermented Soy Milk on D-Galactose-Induced Oxidative Aging Mice. Front. Nutr. 2021, 8, 727467. [CrossRef]
20. Ahmad, A.; Ramasamy, K.; Jaafar, S.M.; Majeed, A.B.A.; Mani, V. Total isoflavones from soybean and tempeh reversedscopolamine-induced amnesia, improved cholinergic activities and reduced neuroinflammation in brain. Food Chem. Toxicol.2014, 65, 120–128. [CrossRef]
21. Chan, Y.-C.; Lee, I.-T.; Wang, M.-F.; Yeh, W.-C.; Liang, B.-C. Tempeh attenuates cognitive deficit, antioxidant imbalance, and amyloid β of senescence-accelerated mice by modulating Nrf2 expression via MAPK pathway. J. Funct. Foods 2018, 50, 112–119. [CrossRef]
22. Kridawati, A.; Hardinsyah, H.; Sulaeman, A.; Rahardjo, T.B.W.; Hogervorst, E. Tempe, Tofu, and Amyloid-β 1–40 Serum Levels in Ovariectomized Rats. J. Alzheimer’s Dis. 2020, 76, 159–163. [CrossRef]
23. Lu, C.; Wang, Y.; Wang, D.; Zhang, L.; Lv, J.; Jiang, N.; Fan, B.; Liu, X.; Wang, F. Neuroprotective Effects of Soy Isoflavones on Scopolamine-Induced Amnesia in Mice. Nutrients 2018, 10, 853. [CrossRef]
24. Yang, H.J.; Zhang, T.; Yue, Y.; Jeong, S.-J.; Ryu, M.-S.;Wu, X.; Li, C.; Jeong, D.-Y.; Park, S. Protective Effect of Long-Term Fermented Soybeans with Abundant Bacillus subtilis on Glucose and Bone Metabolism and Memory Function in Ovariectomized Rats: Modulation of the Gut Microbiota. Foods 2023, 12, 2958. [CrossRef]
25. Zhang, T.; Ryu, M.-S.; Wu, X.; Yang, H.-J.; Jeong, S.J.; Seo, J.-W.; Jeong, D.-Y.; Park, S. Alleviation of Neuronal Cell Death and Memory Deficit with Chungkookjang Made with Bacillus amyloliquefaciens and Bacillus subtilis Potentially through Promoting Gut-Brain Axis in Artery-Occluded Gerbils. Foods 2021, 10, 2697. [CrossRef] [PubMed]
26. Zheng, Y.; Yasuda, M.; Yamao, M.; Gokan, T.; Sejima, Y.; Nishikawa, T.; Katayama, S. Fermented soybean foods (natto) ameliorate age-related cognitive decline by hippocampal TAAR1-mediated activation of the CaMKII/CREB/BDNF signaling pathway in senescence-accelerated mouse prone 8 (SAMP8). Food Funct. 2023, 14, 10097–10106. [CrossRef]
27. Hwang, Y.H.; Park, S.; Paik, J.-W.; Chae, S.-W.; Kim, D.-H.; Jeong, D.-G.; Ha, E.; Kim, M.; Hong, G.; Park, S.-H.; et al. Efficacy and Safety of Lactobacillus plantarum C29-Fermented Soybean (DW2009) in Individuals with Mild Cognitive Impairment: A 12-Week, Multi-Center, Randomized, Double-Blind, Placebo-Controlled Clinical Trial. Nutrients 2019, 11, 305. [CrossRef] [PubMed]
28. Handajani, Y.S.; Turana, Y.; Yogiara, Y.; Widjaja, N.T.; Sani, T.P.; Christianto, G.A.M.; Suwanto, A. Tempeh Consumption and Cognitive Improvement in Mild Cognitive Impairment. Dement. Geriatr. Cogn. Disord. 2020, 49, 497–502. [CrossRef]
29. Jung, S.M.; Haddad, E.H.; Kaur, A.; Sirirat, R.; Kim, A.Y.; Oda, K.; Rajaram, S.; Sabate, J. A Non-Probiotic Fermented Soy Product Reduces Total and LDL Cholesterol: A Randomized Controlled Crossover Trial. Nutrients 2021, 13, 535. [CrossRef]
30. Jung, S.M.; Kaur, A.; Amen, R.I.; Oda, K.; Rajaram, S.; Sabatè, J.; Haddad, E.H. Effect of the Fermented Soy Q-CAN(R) Product on Biomarkers of Inflammation and Oxidation in Adults with Cardiovascular Risk, and Canonical Correlations between the Inflammation Biomarkers and Blood Lipids. Nutrients 2023, 15, 3195. [CrossRef] [PubMed]
31. Luca, M.; Luca, A.; Calandra, C. The Role of Oxidative Damage in the Pathogenesis and Progression of Alzheimer’s Disease and Vascular Dementia. Oxidative Med. Cell. Longev. 2015, 2015, 504678. [CrossRef] [PubMed]
32. Nordestgaard, L.T.; Christoffersen, M.; Frikke-Schmidt, R. Shared Risk Factors between Dementia and Atherosclerotic Cardiovascular Disease. Int. J. Mol. Sci. 2022, 23, 9777. [CrossRef]
33. Raz, L.; Knoefel, J.; Bhaskar, K. The neuropathology and cerebrovascular mechanisms of dementia. J. Cereb. Blood Flow Metab. 2016, 36, 172–186. [CrossRef]
34. Xu, L.; Du, B.; Xu, B. A systematic, comparative study on the beneficial health components and antioxidant activities of commercially fermented soy products marketed in China. Food Chem. 2015, 174, 202–213. [CrossRef]
35. Dioletis, E.; Paiva, R.S.; Kaffe, E.; Secor, E.R.;Weiss, T.R.; Fields, M.R.; Ouyang, X.; Ali, A. The fermented soy beverage Q-CANR plus induces beneficial changes in the oral and intestinal microbiome. BMC Nutr. 2021, 7, 6. [CrossRef]
36. Asaoka, D.; Xiao, J.; Takeda, T.; Yanagisawa, N.; Yamazaki, T.; Matsubara, Y.; Sugiyama, H.; Endo, N.; Higa, M.; Kasanuki, K.; et al. Effect of Probiotic Bifidobacterium breve in Improving Cognitive Function and Preventing Brain Atrophy in Older Patients with Suspected Mild Cognitive Impairment: Results of a 24-Week Randomized, Double-Blind, Placebo-Controlled Trial. J. Alzheimer's Dis. 2022, 88, 75–95. [CrossRef]
37. Li, T.; Chu, C.; Yu, L.; Zhai, Q.;Wang, S.; Zhao, J.; Zhang, H.; Chen,W.; Tian, F. Neuroprotective Effects of Bifidobacterium breve CCFM1067 in MPTP-Induced Mouse Models of Parkinson’s Disease. Nutrients 2022, 14, 4678. [CrossRef]
38. Arboleya, S.;Watkins, C.; Stanton, C.; Ross, R.P. Gut Bifidobacteria Populations in Human Health and Aging. Front. Microbiol. 2016, 7, 1204. [CrossRef] [PubMed]
39. Toward, R.; Montandon, S.;Walton, G.; Gibson, G.R. Effect of prebiotics on the human gut microbiota of elderly persons. Gut Microbes 2012, 3, 57–60. [CrossRef]
40. Rajaram, S.; Valls-Pedret, C.; Cofan, M.; Sabate, J.; Serra-Mir, M.; Perez-Heras, A.M.; Arechiga, A.; Casaroli-Marano, R.P.; Alforja, S.; Sala-Vila, A.; et al. The Walnuts and Healthy Aging Study (WAHA): Protocol for a nutritional intervention trial with walnuts on brain aging. Front. Aging Neurosci. 2016, 8, 333. [CrossRef] [PubMed]
41. Messina, M.J.; Nagata, C.; Wu, A.H. Estimated Asian Adult Soy Protein and Isoflavone Intakes. Nutr. Canter 2006, 55, 1–12. [CrossRef]
42. Sala-Vila, A.; Valls-Pedret, C.; Rajaram, S.; Coll-Padros, N.; Cofan, M.; Serra-Mir, M.; Perez-Heras, A.M.; Roth, I.; Freitas-Simoes, T.M.; Domenech, M.; et al. Effect of a 2-year diet intervention with walnuts on cognitive decline. The Walnuts and Healthy Aging (WAHA) study: A randomized controlled trial. Am. J. Clin. Nutr. 2020, 111, 590–600. [CrossRef] [PubMed]
43. Park, S.-H.; Lee, H. Is the center for epidemiologic studies depression scale as useful as the geriatric depression scale in screening for late-life depression? A systematic review. J. Affect. Disord. 2021, 292, 454–463. [CrossRef] [PubMed]
44. Moeller, J. A word on standardization in longitudinal studies: Don’t. Front. Psychol. 2015, 6, 1389. [CrossRef]
45. Kenny, A.M.; Mangano, K.M.; Abourizk, R.H.; Bruno, R.S.; E Anamani, D.; Kleppinger, A.; Walsh, S.J.; Prestwood, K.M.; E Kerstetter, J. Soy proteins and isoflavones affect bone mineral density in older women: A randomized controlled trial. Am. J. Clin. Nutr. 2009, 90, 234–242. [CrossRef]
46. Turana, Y.; Handajani, Y.S.; Barus, T.; Kristian, K.; Theodoraliu, E.; Suswanti, I. Comparison of the effects of mixed tempeh with soy tempeh on cognitive function in older people. Front. Nutr. 2025, 12, 1551211. [CrossRef]
47. Messinis, L.; Nasios, G.; Mougias, A.; Politis, A.; Zampakis, P.; Tsiamaki, E.; Malefaki, S.; Gourzis, P.; Papathanasopoulos, P. Age and education adjusted normative data and discriminative validity for Rey’s Auditory Verbal Learning Test in the elderly Greek population. J. Clin. Exp. Neuropsychol. 2016, 38, 23–39. [CrossRef]
48. Cui, C.; Birru, R.L.; E Snitz, B.; Ihara, M.; Kakuta, C.; Lopresti, B.J.; Aizenstein, H.J.; Lopez, O.L.; A Mathis, C.; Miyamoto, Y.; et al. Effects of soy isoflavones on cognitive function: A systematic review and meta-analysis of randomized controlled trials. Nutr. Rev. 2020, 78, 134–144. [CrossRef]
49. de Oliveira Silva, F.; Lemos, T.C.; Sandôra, D.; Monteiro, M.; Perrone, D. Fermentation of soybean meal improves isoflavone metabolism after soy biscuit consumption by adults. J. Sci. Food Agric. 2020, 100, 2991–2998. [CrossRef] [PubMed] 50. Sanjukta, S.; Rai, A.K. Production of bioactive peptides during soybean fermentation and their potential health benefits. Trends Food Sci. Technol. 2016, 50, 1–10. [CrossRef]
51. Ketnawa, S.; Ogawa, Y. Evaluation of protein digestibility of fermented soybeans and changes in biochemical characteristics of digested fractions. J. Funct. Foods 2019, 52, 640–647. [CrossRef]
52. Jang, C.H.; Oh, J.; Lim, J.S.; Kim, H.J.; Kim, J.-S. Fermented Soy Products: Beneficial Potential in Neurodegenerative Diseases. Foods 2021, 10, 636. [CrossRef]
53. Ju, D.-T.; K, A.K.; Kuo, W.-W.; Ho, T.-J.; Chang, R.-L.; Lin, W.-T.; Day, C.H.; Viswanadha, V.V.P.; Liao, P.-H.; Huang, C.-Y. Bioactive Peptide VHVV Upregulates the Long-Term Memory-Related Biomarkers in Adult Spontaneously Hypertensive Rats. Int. J. Mol. Sci. 2019, 20, 3069. [CrossRef]
54. Weiser, M.J.; Foradori, C.D.; Handa, R.J. Estrogen receptor beta in the brain: From form to function. Brain Res. Rev. 2008, 57, 309–320. [CrossRef]
55. Almeida, J.; Martins, A.R.; Amaral, L.; Valerio, D.; Bukhari, Q.; Schu, G.; Nogueira, J.; Spinola, M.; Soleimani, G.; Fernandes, F.; et al. The cerebellum is causally involved in episodic memory under aging. GeroScience 2023, 45, 2267–2287. [CrossRef] [PubMed]
56. Dreyfus, B.; Kuri, L.; Ferri, M.; Doykos, P.; Fazeli, M.S.; Hofer, K.; Andonova, A.; Ferri, L. Understanding Hispanic/Latino Participation in Clinical Trials and Observational Studies, and Strategies to Increase Participation: A Targeted Literature Review. J. Health Care Poor Underserved 2023, 34, 399–424. [CrossRef] [PubMed]
https://www.mdpi.com/2072-6643/17/18/2936
免责声明/出版商注:所有出版物中包含的声明、意见和数据仅代表个人作者和撰稿人,而非MDPI和/或编辑。MDPI和/或编辑不对内容中提及的任何想法、方法、说明或产品造成的任何人员或财产伤害负责。
上一页:
下一页: